醫療器材檢測相關專題
特定醫療器材產品功能性檢測分析--體外血液迴路管
撰稿人: 生醫驗證組技術主管 吳秉泫
魏琪珍 博士
為協助業者於醫療器材產品查驗登記時更易了解各品項「臨床前測試」應檢附的相關資料,TFDA特別依據國際標準組織如ISO、IEC所出版的國際標準、OECD指引、美國FDA指引(FDA Guidance)、歐盟公告標準等,彙整比較各項規範內容後,研擬特定醫療器材臨床前測試基準草案,邀請相關領域專家學者進行審查且公諸各界審閱後,完成並公告醫療器材臨床前測試基準。醫療器材輸入或製造業者先行核對公司產品之分類分級基本資料,並確認是否適用相關臨床前測試基準。若適用,即可依據「醫療器材查驗登記準則」第15、17條規定與基準之要求,準備產品查驗登記需檢附的申請資料。
臨床前測試基準的內容包括五大部分,分別為
1. 基準適用之醫療器材範圍
2. 基準適用之醫療器材分類分級品項及鑑別
3. 產品敘述及規格
4. 安全性及功能性測試資料
5. 參考文獻
基準特別針對器材應進行之測試項目(如生物相容性試驗、無菌試驗或功能性試驗等…)、規格需求以及參考方法 (如ISO 10993-5) 予以說明與要求。其中生物相容性、無菌試驗試驗…均為一般測試實驗室施行多年的檢測項目,各項參考規範也明確指出測試方法,較無施行上的困難; 惟醫療器材品項繁多且用途差異性大,建議執行的測試項目迥異而面臨須針對不同醫材客製作試驗的狀況,例如特殊物理/機械特性評估、功能性試驗、有效期限等…,若對參考法規無一定程度的了解、無適當設備、制具與試驗技術,很容易產生無測試實驗室可代醫材廠執行試驗的情況。
財團法人塑膠工業技術發展中心於民國82年成立,以輔導塑膠工業升級轉型為使命,積極投入及協助國內醫療器材廠商的產品得以快速研發及上市,為此驗證技術部針對特定醫材功能性檢測分析建置測試能量,在品質及技術控管的前提下,為醫療器材產品執行上述所列的特殊試驗。
以用於血液透析器之體外血液迴路為例,其由動、靜脈迴路導管所組成,需經滅菌確效並密封包裝,提供洗腎病人進行血液透析時,血液循環與透析器間的連接,為拋棄式一次使用為限。依產品設計不同,雖稍有差異,但一般體外血液迴路包含多項組件,其簡易示意圖如圖1 所示,病患的血液由動脈端廔管穿刺針引出,經由血液幫泵的帶動,依序進入負壓偵測器 (1)、血液泵 (2)、肝素泵(3)、動脈滴注室(6),透析器(7)、靜脈滴注室(9)、空氣氣泡偵測器(10)、血液偵測器(11)、體外管路偵測器(12)與靜脈管夾(13),最後經由靜脈端廔管回送到病患的體內。而動脈滴注室與靜脈滴注室都分別透過血液污染防護器(5a與5a)連接動脈壓力偵測器(4)與靜脈壓力偵測器(8)。
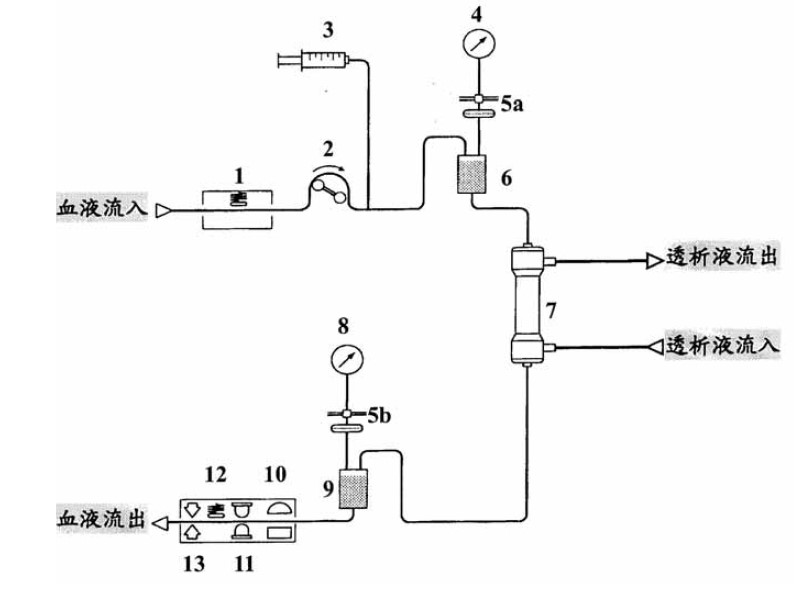
圖1. 典型血液透析設備之體外血液迴路簡易示意圖
病人能否安全且順利地完成透析,最重要的因素取決於血液透析設備的規格與性能。因此,目前世界各先進國家對於血液透析設備的管理,大都制定有相關的標準規範,對於血液透析設備的規格與性能予以要求或控管,來確保血液透析設備之安全性與功效性,以維護血液透析病患的健康。這麼多不同的組件均有其特殊功能,也因此除例行的生物相容性、無菌、熱原試驗外,另外亦涵蓋九大項功能性試驗需執行,以確保血液迴路管能確實發揮其效能,包含結構完整性(Structure integrity)、連接頭 (Connector)、血液流路體積 (Blood pathway volume)、採樣口 (Access port)、轉換器保護蓋 (Transducer protector)、泵節段 (Pump segment)、顏色標記 (Color coding)、空氣捕捉室滿位線 (Air-capture camber fill level)、管路順應性 (Tubing compliance)。這些試驗除需要特殊設備外,執行試驗人員對操作的純熟度也會影響試驗結果及品質,塑膠中心實驗室內已建置的多項設備可依特定試驗項目需要,調整其操作方式及參數設定,使其符合法規要求。
在塑膠中心投注多方面資源,及衛福部的研究計畫支持下,開發及建置體外血液迴路相關的檢測平台,已能準確執行多項試驗,部分國內測試實驗室無法執行的測試項目,亦與國外實驗室合作,將能提供國內相關產品製造廠商高品質的檢測報告。
此外,塑膠中心亦全力推動開發各項客製作試驗,針對目前尚無法規可依循的特定新式醫材產品,搜尋適用的相近法規,並提供專屬的測試規畫,例如產品的功能性驗證、各部件物理與機械性測試、滅菌確效規畫及執行、包裝完整性試驗、產品效期擬定及確認,甚至可依據產品宣稱的功效性,與委託廠商擬定專屬試驗計畫書,於特定細胞模式或動物疾病模式中確認其生物性功能,例如糖尿病、心血管病病、自體免疫疾病、腦部疾病、骨科疾病、癌症…等。這些都是塑膠中心差異化服務推行的重點項目,也希望能藉此提供各項高階醫療器材快速由研發階段進展至成熟產品進而上市的檢測平台。
【聯絡窗口】
| 醫療器材檢測驗證 | |
諮詢專線:(04)23595900 #638 & #643 信箱:md3d@pidc.org.tw LINE 帳號:pidcmd3d  |
