
英國|UKCA Marking (UK MDR 2002)申請輔導

隨著英國(United Kingdom, UK)自 2021 年 1 月 1 日起正式脫離歐盟(European Union, EU),醫療器材進入英國市場將採用嶄新的驗證模式與全新的產品驗證標誌 UKCA 或 CE UK(NI)。
UKCA 是 UK Conformity Assessed 的縮寫,代表「英國符合性評鑑」。如同 CE 標誌,UKCA 也作為產品上的標誌。標示 UKCA 的產品將能夠進入大不列顛(Great Britain, GB)市場,需要注意這裡指的大不列顛市場只包含了英格蘭(England)、蘇格蘭(Scotland)和威爾斯(Wales),其並不包含北愛爾蘭 (Northern Ireland)。
值得注意的是,若產品只有單獨標示 UKCA,將無法進入北愛爾蘭市場。若產品打算進入北愛爾蘭市場,按照北愛爾蘭議定書 (Northern Ireland Protocol)的要求,需要有 CE 標誌或 CE UK(NI) 標誌,UK(NI) 標誌也可以稱為 UKNI 標誌。
【UKCA標誌】
UKCA 標誌是一種專門用於大不列顛市場之產品標誌,UKCA 標誌無法用來進入歐盟、歐洲經濟區(European Economic Area, EEA)或北愛爾蘭市場。若產品打算進入北愛爾蘭市場,需要有 CE 標誌或 CE UK(NI) 標誌。
【CE UK(NI)標誌】
CE UK(NI) 標誌是一種專門用於北愛爾蘭市場之產品標誌,CE UK(NI) 標誌無法用來進入歐盟、歐洲經濟區或大不列顛市場。若產品打算進入大不列顛市場,需要有 UKCA 標誌,或者有CE標誌(僅適用於 2023 年 6 月 30 日緩衝期截止前)。若產品打算進入北愛爾蘭和歐盟市場,需要有 CE 標誌。
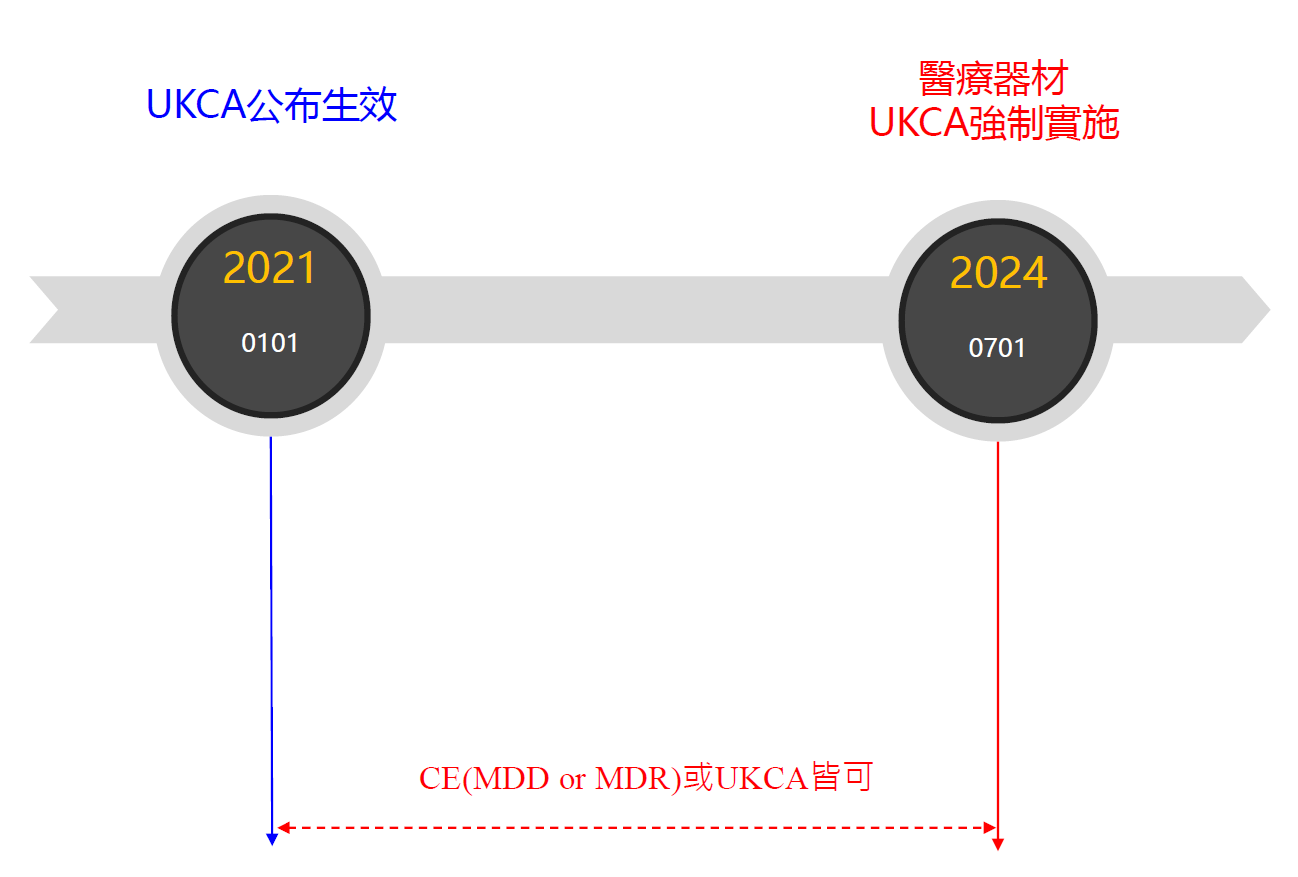
英國政府已經確認 UKCA 標誌將在 2021年1月1日正式生效。不過,英國政府為了讓廠商有充分的時間調整及適應新要求,已將大不列顛市場接受CE標誌的截止期限延後至2022年12月31日;對於醫療器材產品的截止期限則延後至2023年6月30日,所以,自 2023 年 7 月 1 日起,所有要進入大不列顛市場的醫療器材都必須要有 UKCA 標誌。
大不列顛市場與北愛爾蘭市場有著截然不同的法規依據,大不列顛市場採用全新的 UKCA 模式,而北愛爾蘭市場則沿用歐盟的 CE 模式。
【大不列顛市場】
目前 UKCA 所依據的法規為,「Medical Devices Regulations 2002 as amended by EU Exit Regulations of 2019 and 2020」,簡稱 UK MDR 2002。UK MDR 2002 轉換並採納了歐盟MDD、AIMDD 和 IVDD 的法規要求,包含了醫療器材的分類方式與上市後監督(Post-market surveillance)模式,但不包含任何與 MDR 和 IVDR 有關的法規要求。
其中 UK MDR 2002與MDD、AIMDD、IVDD之對應關係如下:
●第二編(Part II):對應到MDD
●第三編(Part III):對應到 AIMDD
●第四編(Part IV):對應到 IVDD
另外,英國正在制訂嶄新的醫療器材法規 Medicines and Medical Devices Act,作為未來醫療器材的法規基礎。
【北愛爾蘭市場】
由於北愛爾蘭市場採用的是 CE 標誌或 CE UK(NI) 標誌,目前醫療器材在北愛爾蘭市場是依照歐盟的 MDD、AIMDD 和 IVDD 進行管理,並將隨著歐盟的 MDR 和 IVDR 分別從 2021 年 5 月 26 日和 2022 年 5 月 26 日開始生效而跟著實施 MDR 和 IVDR。
製造商必須備妥技術文件,來證明醫療器材符合相關法令法規的要求。製造商也必須簽署符合性聲明,以聲明醫療器材符合相關法令法規的要求。製造商亦需保存技術文件和符合性聲明,以備相關主管機關查驗。
【大不列顛市場】
欲進入大不列顛市場的製造商應簽署英國符合性聲明(UK declaration of conformity),並參考英國的指定標準(designated standard):
●指定標準:體外診斷醫療器材(in vitro diagnostic medical devices)
●指定標準:主動式醫療器材(active implantable medical devices)
指定標準涵蓋了BS、EN、EN ISO與EN IEC這四種字母開頭的標準,由於目前BSI仍是歐洲標準委員會(European Committee for Standardization, CEN)與歐洲電子技術標準委員會(European Committee for Electrotechnical Standardization, CENELEC)的成員,EN、EN ISO與EN IEC這三種字母開頭的標準仍可作為指定標準。英國的衛生與社會關懷部(Department of Health and Social Care)已於2021年1月6日公告了276份指定標準供製造商參考,目前這276份指定標準皆屬於歐盟標準(EN standard)。
【北愛爾蘭市場】
欲進入北愛爾蘭市場的製造商則應簽署歐盟符合性聲明(EU declaration of conformity),並參考歐盟的 調和標準(harmonized standard)。
【大不列顛市場:英格蘭、蘇格蘭、威爾斯】
● 以CE標誌進入大不列顛市場:
符合MDD, AIMDD, MDR, IVDD或IVDR
● 以UKCA標誌進入大不列顛市場:
(1) 分類分級:比照MDD, AIMDD, IVDD
(2) 選擇符合性途徑
(3) 依循標準:指定標準(Designated Standard)
(4) 技術文件
(5) 英國批准機構(UK Approved Body) 進行符合性評定審查; 部分醫療器材
透過自我聲明宣稱符合性
(6) 英國的符合性聲明(UK Doc)以及UKCA marking
(7) 上市後通報要求
【北愛爾蘭市場】
● 以CE標誌進入北愛爾蘭市場:
符合MDD, AIMDD, MDR, IVDD或IVDR
● 以CE UK(NI) 標誌進入北愛爾蘭市場:
(1) 分類分級:比照MDD, AIMDD, IVDD
(2) 選擇符合性途徑
(3) 依循標準:調和標準(Harmonized Standard)
(4) 技術文件
(5) 英國公告機構(UK Notify Body) 進行符合性評定審查;部分醫療器材透過
自我聲明宣稱符合性
(6) 歐盟符合性聲明(EU Doc)以及CE UK(NI) marking
(7) 上市後通報要求
| 醫療產業管理系統輔導 | |
| 劉組長 (04)23595900 #303 andy628@pidc.org.tw 0982-920-303 |
|
| 范顧問 (04)23595900 #325 mandyfan@pidc.org.tw 0978-110-207 |
陳顧問 (04)23595900 #333 lilychen0703@pidc.org.tw 0919-602-859 |
