生物領域檢測實驗室輔導
2020年自從COVID-19侵襲全球造成至少三千萬人感染,全球開始重視全球健康照護產業及醫療器材產業,2020年全球醫療器材的市場將達到上億美元,台灣近年醫材廠數不斷增加,已達1,083家,國內各家醫材廠及大藥廠皆開始建立專屬的品保實驗室執行微生物檢測、生物相容性技術,由廠內品檢人員執行微生物培養、生物相容性之技術操作,透過塑中心顧問師導入生物科技相關技術教育訓練,讓實驗室落實品保實驗室品質管理及技術方法建立後以符合廠內要求品管允收值後加以管控醫材廠及大藥廠製程品質。
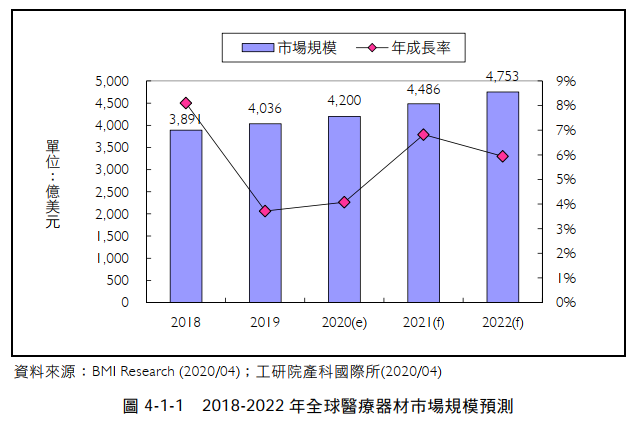
依據BMI Research 的研究報告指出,2019年全球醫療器材市場規模為4,036億美元,預估2022年可成長至4,753億美元,2019-2022年之年複合成長率約5.6%,如下圖。
ISO/IEC 17025生物相容性品保實驗室建置輔導
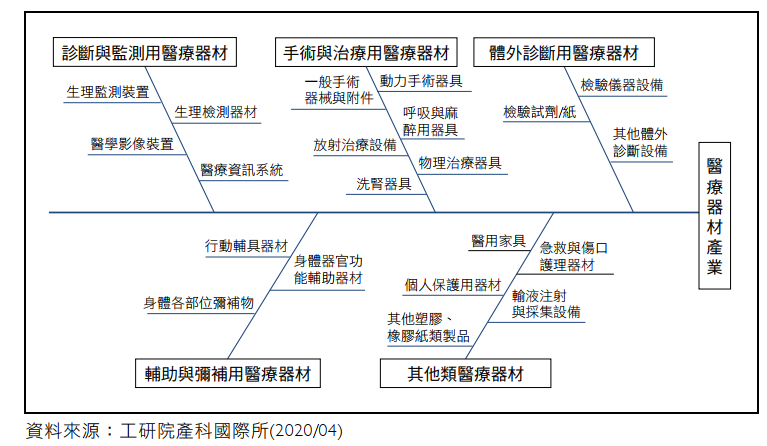
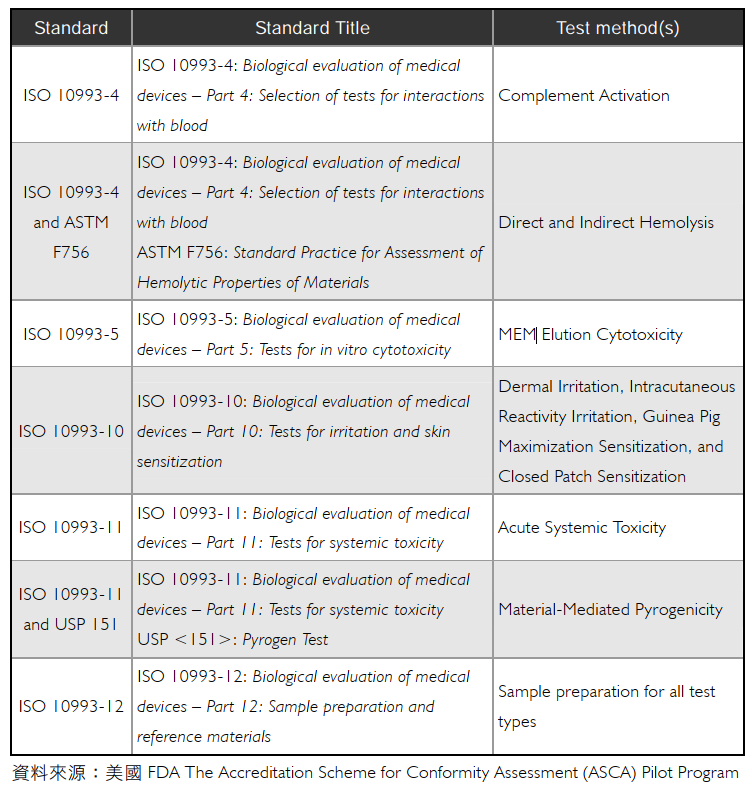
於全球各國針對醫療器材市場的關注,紛紛投入大量研發能量開發創新型醫療器材,而最終都必須通過美國FDA提交上市申請,未來方可販售該產品,於2019年9月20日美國FDA宣布推動「符合性評鑑認證計畫」(The Accreditation Scheme for Conformity Assessment (ASCA)),美國FDA鼓勵認證機構向FDA申請承認其資格和合約以參加試行計畫,認證機構被美國FDA認可為特定的標準和測試範圍,該認證機構可以依據美國ASCA認可ISO/IEC 17025測試實驗室(可以是廠商內部實驗室或第三方實驗室)。依循美國的案例,台灣醫療器材廠商(如下圖、醫療器材產品關聯圖)未來可透過申請通過ISO/IEC 17025測試實驗室,其中須申請的國際規範方法可包含各項生物相容性測試項目(詳如下表、ASCA試行計畫採認標準-醫療器材生物相容性評估),塑膠中心可藉由三軌輔導能量協助廠商建置ISO/IEC 17025測試實驗室並通過認證。
當您的實驗室決定執行滅菌確效時,可透過無菌保證度、負荷菌及無菌試驗等三大生物性的評估來完成產品的滅菌製程評估作業。
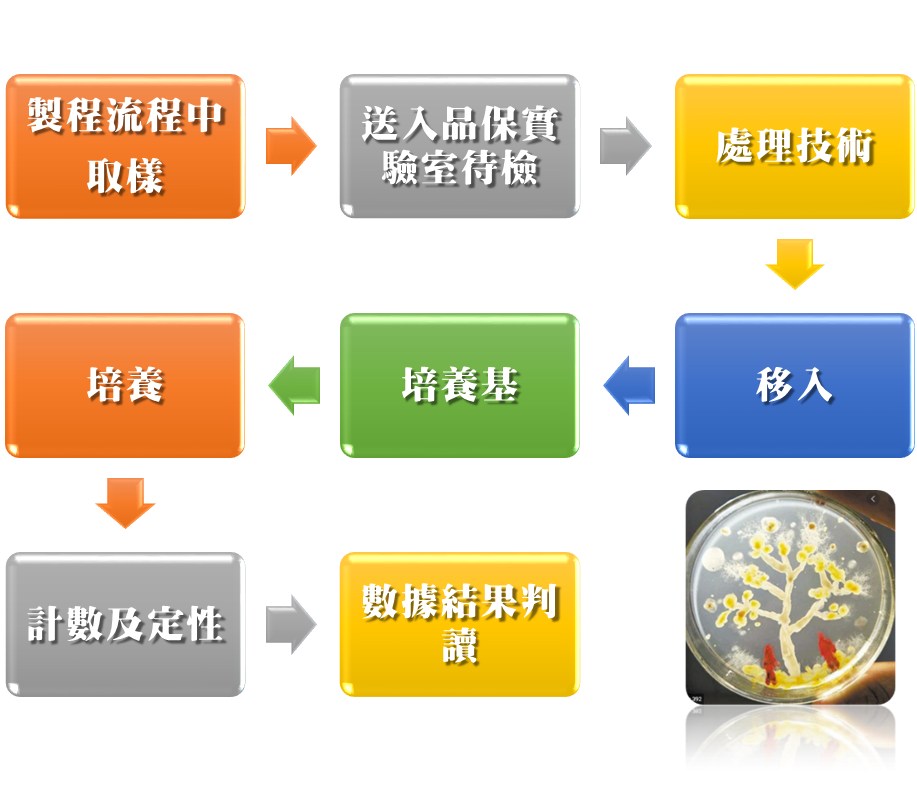
透過塑膠中心建置微生物品保實驗室技術輔導服務優點
- 無需再送樣至外包實驗室執行生物相容性測試或微生物檢測工作,可於廠內快速完成檢測工作,縮短品檢數據的時程,儘速與研發及製程單位討論及調整及修正配方研發及製程參數。
- 透過塑膠中心投入技術輔導可減少廠內研發人員自行建立檢測技術開發時間,迅速建立廠內品檢技術。
- 透過塑膠中心投入技術輔導中以規範解析及實務應用,有效地學習及建立正確的操作流程及SOP,後續加以運用於不同實驗室間能力比對或實驗室內人員能力比對,確保人員訓練及提升人員能力。
【聯絡窗口】
輔導需求單: https://forms.office.com/r/F3e1wTKVDM
(首次詢問請填寫此需求單,會有專人為您服務。)
朱筱鈞 專員
電話: (04)2359-5900 #583
電子郵件: jean13@pidc.org.tw
吳悅婧 副組長
電話: (04)2359-5900 #636
電子郵件: sarahwu1009@pidc.org.tw
陳明坤 經理
電話: (04)2359-5900 #630
電子郵件: cmk@pidc.org.tw
輔導需求單: https://forms.office.com/r/F3e1wTKVDM
(首次詢問請填寫此需求單,會有專人為您服務。)
朱筱鈞 專員
電話: (04)2359-5900 #583
電子郵件: jean13@pidc.org.tw
吳悅婧 副組長
電話: (04)2359-5900 #636
電子郵件: sarahwu1009@pidc.org.tw
陳明坤 經理
電話: (04)2359-5900 #630
電子郵件: cmk@pidc.org.tw
